Antes de explicar el concepto de ecuación química debemos de estudiar lo de las reacciones químicas.
Cuando dos o más sustancias se combinan entre si entonces reaccionan y
origina una o más sustancias nue nuevas; es decir, las reacciones
químicas significan cambios químicos o intercambios de átomos entre las
sustancias que se combinan. Esto es que, uno o más átomos de una de las
sustancias combinadas se separan y luego se unen a la otra sustancia, e
igual puede suceder en la otra sustancia, produciéndose así un reacomodo
de átomos y, por lo tanto, nuevas sustancias.
En
la combinación de dos o más sustancias puras no hay re-acomodo de
átomos, sino que estos simplemente se u - nen o enlazan. Lo que sucede
dentro de las reacciones químicas no puede ser apreciado por el sentido
de la vista, y ni siquiera mediante el mejor de los microscopios; sin
embargo, el hombreha razonado esta situación y ha sabido ex plicarla por escrito mediante las ecuaciones químicas.
a. Concepto de ecuación química. Es la representación escrita de una reacción química, mediante símbolos.
Usted
ya comprende lo que es una reacción química; ahora bien, mediante una
ecuación química se explica en qué tipo de sustancias se convierten
aquellas sustancias que se combinan; y esta explicación se hace
abreviadamente y por escrito, mediante símbolos y números.
A veces los elementos químicos que forman a una sustancia compuesta se separan químicamente con solo aplicar les calor,
y así se originan nuevas sustancias, lo cual es también una reacción
química y, por lo tanto, hay una ecua - ción química para ello. En
resumen, en una ecuación química se muestran las sustancias y sus
respectivas cantidades que se combinan (llamadas reactivos), así como
también las sustancias que se producen (nuevas) o que resultan de tal
combinación (productos).
b. Partes de una ecuación. Una ecuación está formada por varias partes, las cuales se pueden agrupar de dos maneras: reactivos y productos, y símbolos y números.
Reactivos
y productos. Las sustancias que se combinan se llaman reactivos, y se
localizan a la izquierda de la ecua- ción; y a las sustancias que
resultan de tal combinación se les nombra productos (sustancias nuevas),
localizadas a la derecha de la ecuación. Por ejemplo, cuando el
Hidrogeno se combina con Oxigeno (reactivos) reaccionan y originan una
nueva sustancia llamada agua (producto); esta reacción química se puede representar mediante una ecuación denominada ecuación del agua, así:
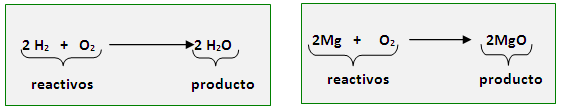
Observe
que los reactivos siempre se colocan a la izquierda de la flecha (que
significa "se origina o produce"), y los productos a la derecha de la
misma. Otros ejemplos de ecuaciones, ya balanceadas, son:

Símbolos y números. Otra manera de dividir a las partes de una ecuación es en símbolos y números.
En una ecuación existen tres tipos de símbolos:

En cuanto a los números, existen dos tipos de ellos en una ecuación:
- Enteros y grandes, llamados coeficientes.
- Enteros y pequeños, llamados sub-índices.
El
coeficiente es el numero grande que va situado por delante de todos los
símbolos de la formula, e indica la can - tidad de moléculas de la
sustancia de que se trate; cuando no aparece un coeficiente en la
fórmula es porque se su pone que es uno (1), el cual no se escribe, lo
que también se aplica para el sub-índice. Cuando el coeficiente se mul
tiplica por el subíndice resulta el total de átomos del elemento químico
que lo lleva en la formula, esto es que, el co coeficiente afecta a
todos los sub-índices de una formula.
Respecto
al sub-índice, este es un número pequeño que se localiza en la parte
inferior derecha de cada símbolo quí mico, y que indica la cantidad de
átomos del elemento. Así mismo, cuando en el símbolo químico no aparece
el sub -índice es porque se supone que es uno (1), el cual no se
escribe. Observe los símbolos y números en la siguiente ecua ción del
agua:

c. Cálculos en una ecuación.
A partir de cualquier ecuación se pueden realizar los siguientes cálculos u operaciones, que se han denominado "cálculos ecuacionales":
- Cantidad de sustancias presentes en la ecuación.
- Cantidad de moléculas por cada sustancia de la ecuación.
- Total de átomos de cada sustancia de la ecuación.
- Cantidad de átomos que forman a una sola molécula de cada sustancia.
Si se toma como ejemplo la ecuación balanceada del agua, entonces estos cálculos se realizan de la manera siguiente:
